கந்தக டைஆக்சைடு

| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
சல்ஃபர் டைஆக்சைடு
| |
| வேறு பெயர்கள்
சல்ஃபரசு ஆன்ஐதரைடு
சல்ஃபர்(IV) ஆக்சைடு | |
| இனங்காட்டிகள் | |
| 7446-09-5 | |
Beilstein Reference
|
3535237 |
| ChEBI | CHEBI:18422 |
| ChEMBL | ChEMBL1235997 |
| ChemSpider | 1087 |
| EC number | 231-195-2 |
Gmelin Reference
|
1443 |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | D05961 |
| ம.பா.த | சல்ஃபர்+டைஆக்சைடு |
| பப்கெம் | 1119 |
| வே.ந.வி.ப எண் | WS4550000 |
| |
| UNII | 0UZA3422Q4 |
| UN number | 1079, 2037 |
| பண்புகள் | |
| SO 2 | |
| வாய்ப்பாட்டு எடை | 64.066 கி மோல்−1 |
| தோற்றம் | நிறமற்ற வளிமம் |
| மணம் | Just-struck match/eggs like |
| அடர்த்தி | 2.6288 கிகி மீ−3 |
| உருகுநிலை | −72 °C; −98 °F; 201 K |
| கொதிநிலை | −10 °C (14 °F; 263 K) |
| 94 கி/லிட்[1] | |
| ஆவியமுக்கம் | 237.2 kPa |
| காடித்தன்மை எண் (pKa) | 1.81 |
| காரத்தன்மை எண் (pKb) | 12.19 |
| பிசுக்குமை | 0.403 cP (0 °செ) |
| கட்டமைப்பு | |
| புறவெளித் தொகுதி | C2v |
| ஒருங்கிணைவு வடிவியல் |
Digonal |
| மூலக்கூறு வடிவம் | |
| இருமுனைத் திருப்புமை (Dipole moment) | 1.62 D |
| வெப்பவேதியியல் | |
| Std enthalpy of formation ΔfH |
-296.81 கிஜூ மோல்−1 |
| நியம மோலார் எந்திரோப்பி S |
248.223 ஜூ கெ−1 மோல்−1 |
| தீங்குகள் | |
| ஈயூ வகைப்பாடு | |
| R-சொற்றொடர்கள் | R23, R34, R50 |
| S-சொற்றொடர்கள் | (S1/2), S9, S26, S36/37/39, S45 |
| Lethal dose or concentration (LD, LC): | |
LD50 (Median dose)
|
3000 ppm (30 min inhaled, mouse) |
| தொடர்புடைய சேர்மங்கள் | |
| கந்தகம் ஆக்சைடுகள் தொடர்புடையவை |
சல்ஃபர் மோனாக்சைடு சல்ஃபர் டிரைஆக்சைடு |
| தொடர்புடைய சேர்மங்கள் | ஓசோன் செலேனியம் டைஆக்சைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
கந்தக ஈராக்சைடு (Sulfur dioxide, sulphur dioxide, சல்பர் டைஆக்சைடு) என்பது SO
2 என்ற மூலக்கூறு வாய்பாடு கொண்ட ஒரு கந்தகச் சேர்மம் ஆகும். சாதாரண நிலையில் இது காரம் எரிச்சல், மற்றும் அழுகிய மணம் கொண்ட ஒரு நச்சு வாயுவாக காணப்படுகின்றது. இதன் மும்மைப் புள்ளி 197.69 கெ, 1.67kPa ஆகும். இது இயற்கையாக எரிமலைகளில் இருந்து வெளியேறுகின்றது.
கந்தக டைஆக்சைடு உரோமானியர்களினால் வைன் தயாரிப்புகளில் பயன்படுத்தப்பட்டது. வெற்று வைன் பாத்திரங்களில் எரியும் கந்தக மெழுகுவர்த்திகளை வைக்கும் போது புளிங்காடிகளின் மணம் அற்றுப் போவதாக அவர்கள் கண்டுபிடித்தனர்.[2]
அமைப்பு மற்றும் பிணைப்பு
[தொகு]கந்தக ஈராக்சைடு SO2, C2v சமச்சீர் புள்ளியில் வளைந்த ஒரு மூலக்கூறு ஆகும். இணைதிறன் பிணைப்புக் கோட்பாட்டு அணுகுமுறையில் s மற்றும் p ஆற்றல் மட்டங்கள் ஒத்ததிர்வு அடிப்படையில் இருவேறு ஒத்ததிர்வு கட்டமைப்பு பிணைப்புகளை விவரிக்கின்றன.
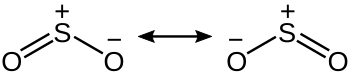
கந்தக ஈராக்சைடில் உள்ள கந்தக - ஆக்சிசன் பிணைப்பு 1.5 பிணைப்பு ஒழுங்கில் அமைந்துள்ளது. இணைதிறன் பிணைப்புக் கோட்பாட்டு அணுகுமுறை d ஆற்றல் மட்டம் பிணைப்பில் ஈடுபடுகிறது என்பதை ஆதரிக்காதது[3] எளிய இந்த அணுகுமுறைக்கு வலுவூட்டுகிறது. எலக்ட்ரான் எண்ணிக்கைக் கோட்பாட்டின்படி கந்தகத்தின் ஆக்சிசனேற்ற நிலை எண் +4 ஆகவும் முறையான மின்னோட்டம் +1 ஆகவும் உள்ளது.
தோற்றம்
[தொகு]இது பூமியின் மீது வளிமண்டலத்தில் மிகச் சிறிய அடர்த்தியாக சுமார் 1 ppb (ஒரு பில்லியனுக்கு 1 பகுதி) அளவில் காணப்படுகிறது.[4][5] ஏனைய கோள்களில், இது பல்வேறு செறிவு அளவுகளில் காணப்படலாம், வெள்ளியில் மிகவும் குறிப்பிடத்தக்க அளவில் இது காணப்படுகிறது. வெள்ளியின் வளிமண்டலத்தில் மூன்றாவது அதிக அளவு வாயுவாக சுமார் 150ppm கந்தக ஈராக்சைடு உள்ளது. அங்கு, இது மேகங்களாக உறைந்தும், கோளின் வளிமண்டல இரசாயன எதிர்வினைகளில் ஒரு முக்கிய அங்கமாகவும், புவி வெப்பமடைதலிலும் பங்களிக்கிறது[6] செவ்வாய் கிரகத்தின் தொடக்ககால வெப்பமாதலுக்கு அதன் தாழ்வளி மண்டலத்தில் குறைந்த அளவு அடர்த்தியாக காணப்படுகின்ற 100 ppm,[7] கந்தக டைஆக்சைடு தொடர்பு படுத்தப்படுகிறது. வெள்ளி, செவ்வாய் போன்ற கிரகங்களில் பூமியில் காணப்படுவதைப் போன்றே எரிமலைகள் முதன்மை ஆதாரமாக உள்ளன என்று நம்பப்படுகிறது. மேலும் இவ்வாயு வியாழன் கிரக வளிமண்டலத் தாதுக்களில் சிறிதளவு இருப்பதாகவும் நம்பப்படுகிறது.
தயாரிப்பு
[தொகு]கந்தக அமிலம் பெருமளவில் உற்பத்தி செய்யப் பயன்படும் வேதியல் தொடு தொகுப்பு முறையே கந்தக டைஆக்சைடு வாயு தயாரிப்பிற்கான முதன்மையான வழிமுறையாகும். 1979 ஆம் ஆண்டில் அமெரிக்காவில் உபயோகப்படுத்தப்பட்ட 150000 ஆயிரம் டன் கந்தக டைஆக்சைடில் 23.6 மில்லியன் டன் கந்தக டைஆக்சைடு இம்முறையில் தயாரிக்கப்பட்டதாகும். பெரும்பாலும் கந்தக டைஆக்சைடு கந்தகத்தை எரிப்பதன் மூலமாகவே தயாரிக்கப்படுகிறது. சிறிதளவு கந்தக டைஆக்சைடு இரும்பின் தாதுவான பைரட் மற்றும் பிற சல்பைடு தாதுக்களை காற்றில் வறுத்தல் மூலமாகவும் பெறப்படுகிறது.[8]
எரிதல் வினைகளால் பெறும் வழிமுறைகள்
[தொகு]கந்தகம் அல்லது கந்தகத்தை உள்ளடக்கிய சேர்மங்கள் காற்றில் எரிவதால் கந்தக டைஆக்சைடு விளைபொருளாகக் கிடைக்கிறது.
S + O2 → SO2, ΔH = -297 கிஜூ/மோல்
எரிதல் வினைக்கு உதவியாக திரவமாக்கப்பட்ட கந்தகத்தை (140-150 °C) சிறிய சொட்டுகளாக அதிக பரப்பில் தெளிக்கும் துகள்களாக்கும் தெளிப்பான் முனை வழியாக தெளிக்கலாம். வெப்ப உமிழ் வினையான இவ்வினையில் சுமார் 1000-1600 °C வெப்பம் உமிழப்படுகிறது. இவ்வெப்ப ஆற்றலை நீராவி உற்பத்திக்கு பயன்படுத்தி பின்னர் அதிலிருந்து கணிசமான அளவு மின்சார ஆற்றலையும் பெறமுடியும்[8].
ஐதரசன் சல்பைடு மற்றும் கரிம கந்தக சேர்மங்களும் இவ்வாறே எரிகின்றன. உதாரணமாக,
2 H2S + 3 O2 → 2 H2O + 2 SO2
பைரைட்டு, இசபேலரைட்டு, சீனாபார் ஆகிய சல்பைடு வகை தாதுக்களை காற்றில் வறுக்கும்போதும் SO2 வாயு வெளிப்படுகிறது[9].
4 FeS2 + 11 O2</sub → 2 Fe2O3 + 8 SO2
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
HgS + O2 → Hg + SO2
4 FeS + 7O2 → 2 Fe2O3 + 4 SO2
தொடர்ச்சியான இவ்வினைச் சேர்மானங்களே அதிக அளவு கந்தக டைஆக்சைடு உற்பத்திக்கும் எரிமலை வெடிப்புக்கும் காரணாமாகின்றன. இந்நிகழ்வுகளினால அதிக SO2 வாயு வெளிப்படுகிறது.
ஒடுக்க வினைகளால் பெறும் வழிமுறைகள்
[தொகு]கால்சியம் சல்பேட்டுடன் (CaSO4) கற்கரியைச் சேர்த்து சூடுபடுத்தி கால்சியம் சிலிக்கேட்டு சிமெண்ட்டை பேரளவில் தயாரிக்கும்போது உடன் விளைபொருளாக கந்தக டை ஆக்சைடு உருவாகிறது.
- 2 CaSO4 + 2 SiO2 + C → 2 CaSiO3 + 2 SO2 + CO2
காற்று மாசாக
[தொகு]கந்தக டை ஆக்சைடு காற்றில் உள்ள மாசுகளில் முதன்மையான ஒன்றாகும். இது மனித உடல்நலத்திற்கு தீங்கு விளைவிக்கக்கூடியது. மேலும் இது அமில மழை காரணமாக இருப்பதாக கருதப்படுகிறது. 2006 ஆம் ஆண்டு கணக்கின்படி சீன நாடே இந்த சல்பர் டை ஆக்சைடு மாசினை உலகில் மிக அதிகமாக உண்டாக்கும் நாடாக இருக்கிறது.
மேற்கோள்கள்
[தொகு]- ↑ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. பன்னாட்டுத் தரப்புத்தக எண் 0-8493-0487-3.
- ↑ "Practical Winery & Vineyard Journal Jan/Feb 2009". www.practicalwinery.com. 1 Feb 2009.
- ↑ Cunningham, Terence P.; Cooper, David L.; Gerratt, Joseph; Karadakov, Peter B. and Raimondi, Mario (1997). "Chemical bonding in oxofluorides of hypercoordinatesulfur". Journal of the Chemical Society, Faraday Transactions 93 (13): 2247–2254. doi:10.1039/A700708F.
- ↑ Owen, Lewis A.; Pickering, Kevin T (1997). An Introduction to Global Environmental Issues. Taylor & Francis. pp. 33–. பன்னாட்டுத் தரப்புத்தக எண் 978-0-203-97400-1.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Taylor, J.A.; Simpson, R.W.; Jakeman, A.J. (1987). "A hybrid model for predicting the distribution of sulphur dioxide concentrations observed near elevated point sources". Ecological Modelling 36 (3–4): 269–296. doi:10.1016/0304-3800(87)90071-8. பன்னாட்டுத் தர தொடர் எண்:03043800.
- ↑ Marcq, Emmanuel; Bertaux, Jean-Loup; Montmessin, Franck; Belyaev, Denis (2012). "Variations of sulphur dioxide at the cloud top of Venus’s dynamic atmosphere". Nature Geoscience. doi:10.1038/ngeo1650. பன்னாட்டுத் தர தொடர் எண்:1752-0894.
- ↑ Halevy, I.; Zuber, M. T.; Schrag, D. P. (2007). "A Sulfur Dioxide Climate Feedback on Early Mars". Science 318 (5858): 1903–1907. doi:10.1126/science.1147039. பன்னாட்டுத் தர தொடர் எண்:0036-8075.
- ↑ 8.0 8.1 Müller, Hermann (2005), "Sulfur Dioxide", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, எண்ணிம ஆவணச் சுட்டி:10.1002/14356007.a25_569
- ↑ Shriver, Atkins. Inorganic Chemistry, Fifth Edition. W. H. Freeman and Company; New York, 2010; p. 414.
வெளி இணைப்புகள்
[தொகு]- United States Environmental Protection Agency Sulfur Dioxide page (ஆங்கில மொழியில்)
- International Chemical Safety Card 0074 (ஆங்கில மொழியில்)
- IARC Monographs. "Sulfur Dioxide and some Sulfites, Bisulfites and Metabisulfites" v54. 1992. p131. (ஆங்கில மொழியில்)
- NIOSH Pocket Guide to Chemical Hazards (ஆங்கில மொழியில்)
- CDC – Sulfure Dioxide – NIOSH Workplace Safety and Health Topic (ஆங்கில மொழியில்)
- Sulfur Dioxide, Molecule of the Month (ஆங்கில மொழியில்)

